
7月29日,由雷昶科技主办的Leateck智药行主题活动阶段第三场,特别邀请到PATH GMP顾问高光博士、国药中生质量管理部主任潘海龙先生、丽珠集团信息总监王红楼先生、雷昶科技首席技术官黄东先生,结合各自领域实践经验,深入分享信息化环境下制药行业发展的新洞察,探讨GMP的检查要点、无菌生产的常见缺陷与整改方向、制药数字化规划建设及未来方向等焦点话题。

高光博士从美国FDA、欧盟GMP、WHO预认证的检查考量出发,表示无菌生产和数据性是审查机构的重点关注领域。通过生产制造执行系统MES、培训管理系统TMS、实验室信息管理系统LIMS、质量回顾分析平台QRS,可更好地保障无菌生产和数据性。同时,高光博士分享了她在无菌生产检查领域的实际经验,对无菌保障常见缺陷、环境监测、微生物监测、无菌实验、无菌工艺、警告信引用等多种场景进行深入解析,用详实的案例,为药企带来具体而明确的建设思路。
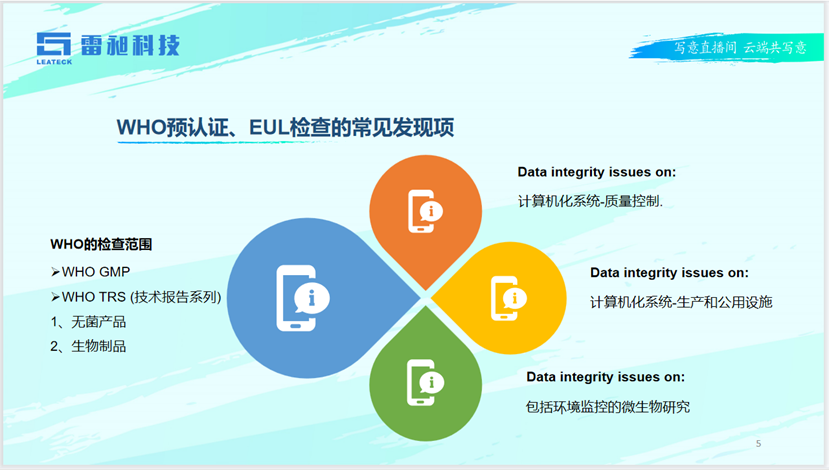
WHO预认证、EUL检查常见发现项
黄东先生从建设效益、建设原则及建设路径出发,分享了制药数字化规划建设的“方法论”。他认为:药企数字化建设首先应建立战略保障,具备跨学科的数字化转型团队(管理、技术、业务、合规),优先规划正确的产品目标和实施路径。对于中国药企来说,数字化转型需要量身定制,在结合法规、制药专业及企业实际的条件下,去挑选产线,分配团队角色,训练技能,获取专家支持,这都是数字化工作开展的基础。在此前提下,药企再进行全业务流程梳理,科学规划,终分阶段地推进数字化建设工作。

数字化建设路径
圆桌讨论阶段,潘海龙先生和王红楼先生围绕药企关注的智能审计管理平台如何运行、Mes实施过程中生产环境与验证环境如何持续保持一致性、WHO或FDA在对A级洁净区的验证(Qualification)过程中有哪些注意事项、集团药企多个系统间的数据如何统一管理等问题展开精彩讨论,为现场观众打开了新的解决思路。

扫描二维码 | 观看全程回放
雷昶科技视频号
感谢十二位专家的三场精彩演讲,Leateck智药行阶段已圆满落幕。活动后续阶段正在火热筹备中,更多行业专家即将加入,欢迎继续关注雷昶科技,也欢迎各位同仁参与!如果您或您的企业希望参与Leateck智药行,请联系:
雷昶科技 021-66790312
如果您有更多问题希望咨询Leateck智药行各位专家,以下是部分专家的咨询邮箱:
1. 顾自强博士:guziqiang@leateckgroup.com (演讲主题:现行GMP系统下的制药数字化生产)
2. 黄伟新博士:huangweixin@leateckgroup.com(演讲主题:数字化生产下LIMS应用)
咨询热线:021-66790312 立即咨询