2022年6月10日,由中国疫苗行业协会主办、上海雷昶科技有限公司协办的《疫苗生产检验电子化记录技术指南》征求意见稿(以下简称“指南”)解读线上研讨会圆满落幕。会议邀请了中国生物技术股份有限公司、上海雷昶科技有限公司以及北京数字认证股份有限公司参与《指南》起草工作的多位专家作为演讲嘉宾,带来《指南》整体框架及实践应用的解析。
本次活动由中国疫苗行业协会秘书长刘大为先生发表开场致辞,国药中生质量管理部主任潘海龙先生主持并从企业的角度给大家带来“疫苗企业信息化构建及对指南解读”主题分享。
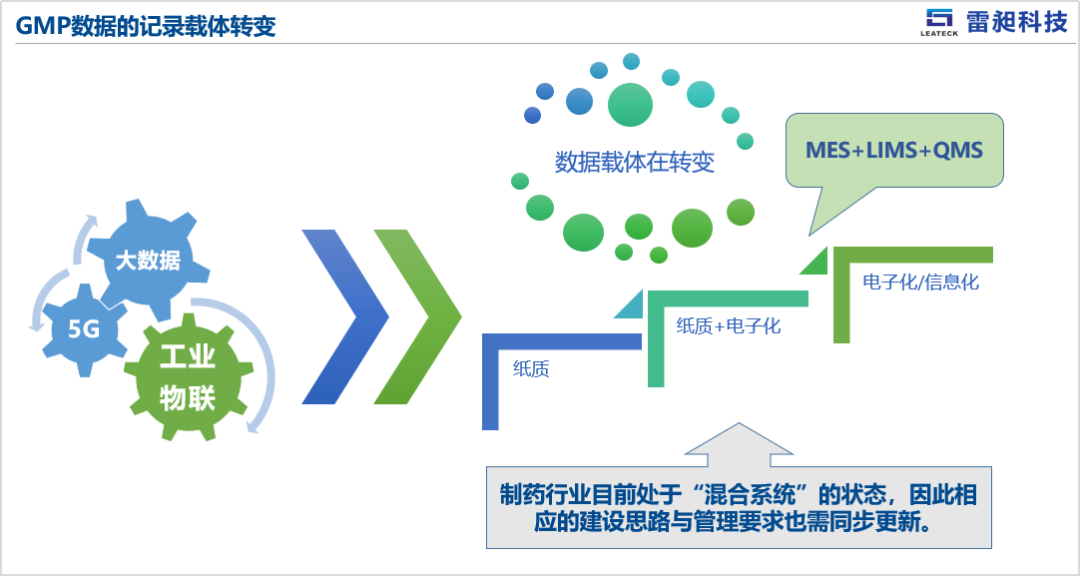
潘海龙先生结合中生的实践经验,指出《指南》的仍是数据性,在形式上可操作性强,可依据企业产品工艺、规模和自身信息化顶层设计要求,选择电子化记录、MES、LIMS甚至QMS等系统。同时,信息化建设是一个庞大的系统性工程,建议优先使用具备完善功能和验证过程的信息化系统,去解决生产和检验过程的信息化问题,而不是大量使用数字化文件来替代。
针对《指南》的系统性解读和实践运用,雷昶科技三位专家进行了多维度的解析。
雷昶科技凭借在药品制造领域的咨询和信息化经验对“指南总体解读及整体信息化要求”展开了重点分享:《指南》总体是对《生物附录》第五十九条的细化,目的是更好地实现疫苗全生命周期追溯;借助电子化“批生产记录”与“批检验记录”避免风险与提升管理,提出数据性、变更控制、备份策略、数据安全和系统验证等方面的规范性要求;鼓励企业积极开展制药全生命周期的数字化转型。
“指南总体解读及整体信息化要求”主题分享
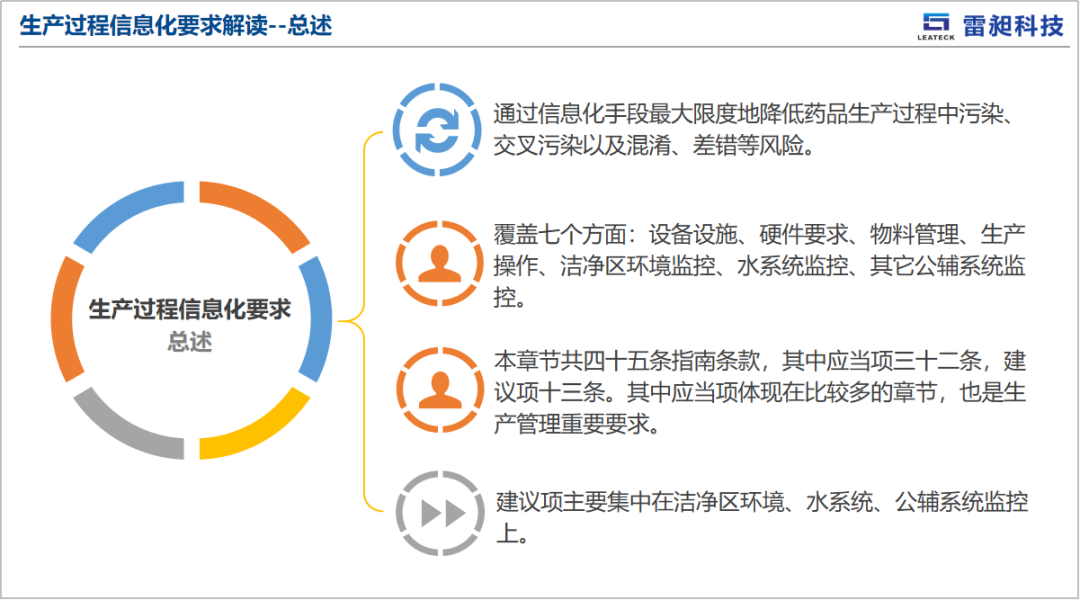
雷昶科技结合生产管理和信息化项目实施经验,从设备设施、硬件要求、物料管理、生产操作、洁净区环境监控、水系统监控、其它公辅系统监控等七个应用场景出发,用生动的语言、清晰的案例,为来宾带来了具体而明确的建设思路。
“指南生产相关要求解读与实践运用”主题分享
在“指南检验相关要求解读与实践运用”的主题分享中,雷昶科技专家指出检验过程信息化管控,是围绕样品检验,通过信息化手段对实验室检验业务流程及相关的人、机、料、法、环、测的全面管理。信息化建设需围绕监管痛点,分阶段逐步实现信息化全面管控。
本次会议从多个层面详实地诠释了《疫苗生产检验电子化记录技术指南》,助力疫苗企业正确地理解监管要求、合规有效地推进信息化建设。未来,中国疫苗行业协会和雷昶科技还将通过更多类似合作形式,加强信息交流共享,共同助力制药行业的信息化建设,为制药数字化转型贡献自己的力量。
扫描二维码 | 观看会议直播回放
雷昶科技视频号



